¿A qué viene tanto revuelo con el fósforo hoy en día, habiéndose llegado incluso a argumentar que las plantas no necesitan los niveles de fósforo recomendados por los especialistas? Los niveles de fósforo recomendados por los expertos en agronomía y fisiología vegetal son precisos, el problema está en las interpretaciones que los equipos de marketing de algunas empresas o las mentes de los que se autodenominan expertos hace de la información.
Las recomendaciones y aplicaciones nutricionales no surgen de la nada, ni están basadas en las interpretaciones que los aficionados hacen de los datos científicos o de las fuerzas kármicas, sino que vienen de la mano de profesionales y están hechas en base a las numerosas variables que se pueden dar según la composición del medio, el tipo de planta, el pH, la temperatura, la humedad, las interacciones entre nutrientes, las necesidades de la planta y los factores económicos, entre otros.
Un primer acercamiento
Para llegar a entender las necesidades de una planta en lo que respecta al fósforo hay que comenzar por lo básico, y ello incluye hablar de una serie de procesos y de otros elementos nutritivos. Pero lo primero de todo es entender cómo funcionan algunos tipos de relaciones para poder comprender tanto la pregunta como la respuesta.
Cada elemento tiene su propio peso: un átomo de nitrógeno pesa menos que uno de oxígeno, el cual pesa menos que uno de magnesio, que a su vez pesa menos que uno de fósforo, y así sucesivamente. Las moléculas son combinaciones de átomos expresadas en los pesos combinados de todos los elementos existentes en la molécula. Los componentes fertilizantes pueden ser sustancias simples (basadas en la forma pura del nutriente, como el calcio) o moleculares (basados en una combinación de átomos como son los nitratos, sulfatos o fosfatos), y así es como son suministrados a la planta para que los asimile, y como están medidos y detallados en las etiquetas de los productos y en los informes. Son muy pocos, o ninguno, los elementos nutricionales que son absorbidos por la planta con la misma forma en que son administrados, ya que para que puedan ser asimilados es necesario que esa forma cambie, que se modifiquen sus propiedades de ionización o que se disocien. Esto es lo que ocurre con el fósforo, el cual requiere de un transportador especial (conocido como simportador H+-HPO42-) que, una vez activado, lo asimile como un ion fosfato.

Todos los componentes nutricionales suministrados a la planta que se encuentran en el área radicular se ven constantemente afectados por los requerimientos de la planta, factores medioambientales tales como temperatura, así como por la interacción con otros elementos y formas de vida, por lo que es necesario entender cómo se toman las muestras para realizar los análisis nutricionales y cómo son realizadas las medidas, de modo que se pueda llegar a una correcta interpretación de los datos resultantes. La mayoría de los elementos tienen sus zonas específicas de mayor concentración en la planta, dependiendo de la planta en sí: por ejemplo, el tejido foliar (mesófilo) tendrá tanto hierro y manganeso como azufre y magnesio. El fósforo está presente en mayores cantidades en la raíz y los tejidos de las flores (especialmente en las semillas). El único modo de obtener un cuadro completo de la composición de una planta es analizarla de arriba abajo: raíces, tallo, hojas, retoños, flores y semillas. Sin embargo, también se puede llegar a conclusiones determinantes con el análisis de tejidos específicos, ya que, por ejemplo, los metabolitos suelen ser buscados directamente en las zonas donde tienden a concentrarse.
Incluso el modo en que los componentes son recogidos, el tiempo que están almacenados o durante el que son transportados, los métodos de extracción utilizados o la maquinaria empleada en su análisis, pueden variar enormemente de unos laboratorios a otros, habiendo siempre uno que ofrezca mayor precisión. El volumen de las muestras recogidas y estudiadas resulta crítico en el análisis estadístico de los resultados; cuanta más variedad de muestras o repeticiones del análisis conformen la base de datos, más precisión tendrán las conclusiones extraídas. La exactitud tanto de la información recogida como de la interpretación de la misma depende de un conocimiento profundo de todos los elementos involucrados en el ensayo; no es lo mismo comparar las manzanas Golden Virginia con otras manzanas Golden Virginia que con la manzana del logotipo de MacIntosh. Hay que tener claro lo que se está buscando; si vas en busca de tiburones al desierto puedes encontrarte con restos de un tiempo pasado en el que ese desierto fue el fondo de un mar, pero no encontrarás la respuesta a la pregunta de cuántos tiburones habitan el planeta hoy en día.
La planta utiliza el fósforo para la formación de componentes tales como azucares fosfato (almacenan y transfieren energía), ácidos nucleicos, nucleótidos, coenzimas, fosfolípidos (membranas), ácido fítico y enlaces de fosfatos de alta energía (ADP, ATP). El principal punto de entrada del fosfato en las rutas de asimilación es la formación del ATP (trifosfato de adenosina), el cual es la “moneda energética” de la célula.
El ATP es lo que proporciona la energía para casi cualquier proceso que tienen lugar en la planta, desde la asimilación de nutrientes a la conversión de compuestos nutricionales (como cuando el nitrato libera nitrógeno), así como a la generación de ADN y la división celular. La fotosíntesis es un proceso ampliamente conocido que produce ATP mediante la fotofosforilación. La respiración es un proceso que produce ATP a través de un proceso de oxidación conocido como fosforilación oxidativa. Al igual que la energía utilizada en los hogares y en la industria es medida en vatios, lo cual nos da el valor de la cantidad de energía necesaria para poner las cosas en funcionamiento, el ATP es utilizado por los bioquímicos para indicar la energía necesaria para que tengan lugar los procesos biológicos.
El grupo fosfato es energía que, una vez incorporada al ATP, puede ser puede ser convertida en otro tipo de energía o ser directamente transferida por medio de diferentes procesos para formar todos los compuestos fosforilados de una planta. Estos grupos pueden formar además otros compuestos de energía con el mismo funcionamiento básico en procesos específicos. La ruta de asimilación es conocida como la asimilación de fosfato. El fosfato resulta necesario para transportar la mayoría de los elementos a la raíces a través de las membranas celulares, y para transformar los nutrientes en elementos que la planta pueda asimilar. Sin fosfato, la planta moriría de hambre o no crecería.
Son varios los elementos que forman parte de los tejidos de una planta. Algunos, como el sodio, pueden ser más específicos de plantas como cactus e hierbas, mientras que otros como el nitrógeno, carbono, fósforo y potasio son necesarios para cualquier forma de vida. Las concentraciones de elementos en los tejidos de las plantas están expresadas en términos de niveles adecuados, lo que se traduce en las cantidades de estos elementos que tienen que estar presentes en las plantas para asegurar su disponibilidad cuando sean requeridos por cualquiera de los muchos metabolitos de las planta o por los procesos que tienen lugar en ellas . Hay niveles que son considerados altos, especialmente los del nitrógeno y los metales pesados, los cuales pueden causar problemas a la planta y especialmente a los animales y formas de vida que se alimentan de ella. La tabla 1 nos da una idea general aunque bastante acertada de los elementos que son necesarios y los niveles en los que son utilizados. En la tabla se puede ver con claridad que mientras que algunos elementos se encuentran en las mismas proporciones, hay sin embargo diferencias en el número de átomos, lo cual nos lleva de vuelta a lo mencionado anteriormente sobre las diferencias en el peso de los átomos. Hidrógeno, carbono y oxígeno son considerados nutrientes esenciales para la planta, pero son obtenidos del aire o del agua y, por lo tanto, no nos interesan en esta discusión.
Las etiquetas
El siguiente aspecto de gran importancia sobre el que hablar tiene que ver con las etiquetas de los productos: cómo interpretarlas, su significado. Hay tantos requisitos diferentes para el etiquetado como países, y en los Estados Unidos tantos como estados lo componen. La función de las etiquetas es dar a conocer al cultivador la concentración de elementos nutricionales y otros constituyentes que forman la mezcla de nutrientes. En este artículo no pretendemos comenzar un debate sobre los tipos de etiquetaje a nivel mundial, sino que nos concentraremos en el mercado norteamericano, por lo que el lector tendrá que tener en cuenta las diferencias entre los mercados y adaptar estos datos al suyo. En la mayoría de los casos las etiquetas con la información sobre los componentes que nos encontramos en los productos son políticamente aceptables, aunque no necesariamente científicamente aceptables, ya que pueden estar basadas en métodos de medición arcaicos y, en el caso del fósforo, la medición puede incluso llegar a estar basada en un derivado de la combustión del compuesto en aire enriquecido. La ciencia, libre de consideraciones políticas, trata de ofrecer el reflejo más exacto posible de los componentes reales. Hay varias formas de representar el contenido de las soluciones fertilizantes; no hay una que se pueda considerar la más exacta, pero sí hay varias políticamente aceptadas, y estas son la de masa/masa (m/m) y la de masa/volumen (m/v). En Norteamérica y otros países se hace con gramos del elemento por kilogramo de fertilizante (m/m).
En todas las etiquetas norteamericanas registradas, los elementos son dados como un porcentaje de la composición en peso: por cada kilogramo (o libra) de material fertilizante hay X% de peso de cada nutriente. En general, las tres cantidades mayores, y las que primero aparecen en la etiqueta del producto (ya sea en la frontal, en la posterior o en ambas), son las de nitrógeno, fósforo y potasio (N – P - K): por ejemplo, 10 – 10 – 10. Los otros elementos suelen aparecer en la sección de “análisis garantizados” de la etiqueta en el mismo formato porcentual, aunque solo en los casos en que la compañía quiera ofrecer garantía sobre esos datos. N – P – K son elementos macronutrientes y son considerados elementos mayores, pero entre los macronutrientes se incluyen también otros elementos (ver Tabla 1).
Tabla 1: Niveles adecuados en los tejidos de las plantas
| Elemento | Símbolo químico | Concentración de materia seca (% o ppm) | Número relativo de átomos comparado con el molibdemo |
|---|---|---|---|
| No mineral Hidrógeno Carbono Oxígeno |
H C O |
6.0 45.0 45.0 |
60,000,000 40,000,000 30,000,000 |
| Macronutrientes Nitrógeno Potasio Calcio Magnesio Fósforo Azufre Silicio |
N K Ca Mg P S Si |
1.5 1.0 0.5 0.2 0.2 0.1 0.1 |
1,000,000 250,000 125,000 80,000 60,000 30,000 30,000 |
| Micronutrientes Cloro Hierro Boro Manganeso Sodio Zinc Cobre Níquel Molibdemo |
Cl Fe B Mn Na Zn Cu Ni Mo |
100 100 20 50 10 20 6 0.1 0.1 |
3,000 2,000 2,000 1,000 400 300 100 2 1 |
Los elementos no minerales (H,C,O) y los macronutrientes están expresados en porcentajes.
Los elementos micronutrientes están expresados en ppm.
Fuente: Epstein 1972, 1999
Actualmente, los elementos nutricionales están clasificados en microelementos y macroelementos, dependiendo de la cantidad relativa que la planta utilice de cada uno de ellos. El término componente es utilizado a consciencia debido a que podría tratarse de una molécula y no de un elemento simple; por ejemplo, el fósforo (P) es medido como pentóxido de difosforo (P2O5, también conocido como óxido de fósforo), y el potasio (K) como óxido de potasio (K2O). Esto se traduce en que la medida porcentual del peso ofrecida no se refiere únicamente al peso del elemento en cuestión, sino que incluye también a los demás elementos que componen la molécula, como el oxígeno en este caso. El dato del nitrógeno (N), por otro lado, hace referencia únicamente al nitrógeno, pero será en la sección del análisis garantizado donde se detalle de dónde proviene dicho nitrógeno, y será indicado como el porcentaje de nitrógeno como derivado; diferentes formas de nitrógeno actuarán de diferentes modos y tendrán propiedades diferentes. Estos ejemplos nos muestran que, aunque los porcentajes detallados en las etiquetas puedan ser correctos, no todo es tan sencillo como parece, ya que se deben realizar unos cálculos para llegar a conocer realmente en qué consiste las cantidades que estamos suministrando. Cuando sean utilizadas dos o tres partes, como ocurre con algunos fertilizantes líquidos, es recomendable sumar los elementos.
A continuación os mostramos un ejemplo del cálculo para determinar las concentraciones reales de los elementos nutritivos según aparecen en la etiqueta de un producto en Norteamérica, donde los porcentajes están detallados en masa/masa:
Un cubo de 50 libras de fertilizante líquido con valores de N-P-K de 10–20–10 (un supuesto ratio de 1:2:1) incluye la siguiente información adicional en el apartado del análisis garantizado de la etiqueta:
- Nitrógeno total (N)…………………….. 10%
- 10% nitrato de nitrógeno
- Fosfato disponible (P2O5)……........….20%
- Potasa soluble (K2O).…….…………....10%
Esto significa que el 10% de 50 libras, o 5 libras, is nitrógeno simple, ya que aparece solo como N y no como un compuesto, que el 20% de 50 libras, o 5 libras, es P2O5, y que el 10% de 50 libras, o 5 libras es K2O. Estos son los porcentajes comerciales que muestra la etiqueta del fertilizante. Para averiguar los porcentajes de los elementos simples, y no como compuestos, es necesario realizar una conversión, ya que los pesos tanto del potasio como del fósforo incluyen óxidos. En este ejemplo, el porcentaje real de fósforo en la forma de óxido (P2O5) es 44% y el de potasio 83%, de modo que el peso real de fósforo es 4,4 libras (10 x 0.44) y el del potasio 4.15 (5 x 0.83), con lo que las cantidades correctas de la relación N-P-K serían 10%-8.8%-8.3%.
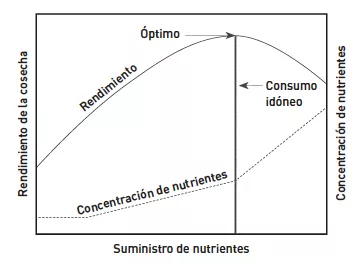
El ratio real de los elementos simples en este ejemplo es 1.0:0.88:0.83 N-P-K, y no el 1:2:1 indicado por la etiqueta. El resto de elementos, ya hayan sido medidos como compuestos, como en el caso de los sulfatos, o en su forma simple, son expresados en la etiqueta siempre en su forma elemental, como en el caso del nitrógeno.
Con medidas masa/volumen los números variarían y también estarían basados en densidades específicas. Un ejemplo de ello sería un aditivo fertilizante para raíces y flores cuya convención masa/masa en Norteamérica sería 0–10–11 N-PK y en masa/volumen sería 0–13–14, dependiendo del material del que derive. La proporción es lo realmente importante, la cantidad suministrada de cada elemento; el uso de valores mayores o menores, siempre que sus proporciones sean similares, solo es relevante en cuanto a la cantidad del fertilizante suministrada.
Cada especie o, en ocasiones, variedad de planta, tiene asignado un ratio determinado dependiendo de sus necesidades; aunque hay muchas plantas que tienen necesidades similares y puedan ser agrupadas según estas. De tres fertilizantes con proporciones diferentes pero similares, 0–10 –11, 0–20–22 y 0–30–33, lo único que habrá que ajustar es la cantidad suministrada en función de las necesidades de la cosecha, ya que el área radicular tendrá que disponer de una determinada cantidad de nutrientes para la planta mientras la planta los necesite, y son muchas las variables que afectarán a esta disponibilidad de nutrientes en el camino del nutriente desde su envase a donde serán finalmente utilizados por la planta.
Valores limitantes
Los valores limitantes son los de aquellos factores que limitan la velocidad de crecimiento y desarrollo de cualquier planta o forma de vida. Tanto el dióxido de carbono (CO2) del aire, como el agua del suelo o los elementos simples tienen una disponibilidad limitada que determinará el desarrollo de las plantas, por lo que son conocidos como factores limitantes. Se pueden suministrar los niveles y cantidades perfectas de un fertilizante a una planta, pero si no hay suficiente carbono (C) disponible debido a una falta de CO2 en el aire, la planta no será capaz de asimilar todos esos nutrientes ni será capaz de procesar elementos estructurales o llevar a cabo otros procesos, por lo que su sistema fallará; el factor limitante en este caso sería el carbono.
El objetivo de cualquier sistema es asegurar que los niveles adecuados de todos los componentes suministrados son mantenidos en el tiempo y ajustados cuando es necesario. Una planta requiere de diferentes cantidades de los elementos nutricionales dependiendo del momento o estado de su desarrollo. Como se ha mencionado anteriormente, las proporciones suministradas de los elementos más nutritivos deberían ser similares a los niveles requeridos aconsejados, porque estos elementos tienden a acumularse en los tejidos de la planta, pudiendo, en exceso, llegar a resultar tóxicos tanto para la planta como para el animal que la consume . El ratio del área radicular se asemeja al de la composición general de los tejidos de una planta; es esta concentración global la que da problemas a los cultivadores debido las quemaduras causadas por exceso de sales. Existen otros factores que también pueden determinar la disponibilidad de nutrientes, como el pH, la composición del sustrato o la formulación de la solución de nutrientes, por lo que no servirá de nada aplicar los niveles adecuados de N-P-K si, por ejemplo, el pH no es el correcto, ya que esto causará que haya una mayor o menor disponibilidad de los nutrientes suministrados que acabará reflejándose en la composición del tejido.
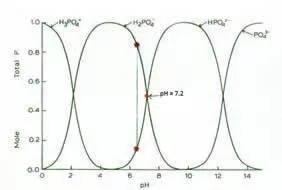
Existen varios ingredientes o métodos que se pueden utilizar para elaborar un fertilizante, por ejemplo, el nitrógeno puede ser añadido como nitrato de amonio, nitrato de potasio, nitrato de calcio, urea, etc., pero cada uno trae consigo otros componentes a la mesa. El fósforo puede ser añadido como superfosfato, superfosfato triple, fosfato monopotásico, fosfato de amonio o harina de huesos, entre otros. Cada uno de ellos debe ser 'activado', descompuesto o ionizado en el área radicular para poder ser asimilado posteriormente por la planta en alguna de las tres formas de fosfato que esta puede absorber. El pH del entorno influirá en la estructura de los fosfatos limitando la disponibilidad de la deseada forma monovalente H2PO4-, la cual se da con niveles normales de pH de entre 5.2 y 7.2, ya que los fosfatos serán convertidos en H3PO4, forma de fosfato que no puede ser asimilada por la planta, o en HPO42-, forma divalente menos deseada (ver Gráfico 1).
Los fosfatos también podrán unirse a otros elementos así como a partículas del sustrato, dejando de estar disponibles para la planta incluso cuando aun estén presentes en el sistema. Los fertilizantes deben estar diseñados no solo para proporcionar las proporciones adecuadas de los elementos en las cantidades necesarias, sino también para funcionar correctamente en entornos sometidos a fluctuaciones de la temperatura y del pH, así como en diferentes sustratos.
Bibliografía
- Brady, Nyle C., and Ray R. Wells. The Nature and Properties of Soils. 13th . Upper Saddle River, NJ: Prentice Hall, 2001.
- Epstein, E. Mineral Nutrition of Plants: Principles and Perspectives. New York: Wiley, 1972.
- Epstein, E. "Silicon." Annu. Rev. Plant Physiol. Plant Mol. Biol. 50 (1999): 641-664.
- Paul, E. A., and F. E. Clark. Soil Microbiology and Biochemistry. 2nd. San Diego: Academic Press, 1996
- Plant Research, B.V., interview by Geary Coogler. Conversations on Phosphorous Utilization Oosterhout, (October 27, 2009).
- Schwarz, A., W. Wilcke, and W. Zech. "Heavy Metal Release from Soils in Batch pH(stat) Experiments." Soil Sci. Soc. Am. J. 63 (1999): 290-296
- Taiz, L., and E. Zeiger. Plant Physiology. 3rd. Sunderland: Sinauer Associates, Inc., 2002.
- Yamagata, M., and A. E. Noriharu. "Direct Acquisition of Organic Nitrogen by Crops." JARQ 33, no. 1 (January 1999): 15-21.